Trouvez-vous qu’équilibrer l’équation chimique est une tâche ardue ? Si oui, vous pouvez également vous perdre en jouant avec les molécules et les atomes. Il faut équilibrer l’équation chimique quoi qu’il arrive, selon la loi de conservation de la matière, mais de nombreux étudiants ont du mal à l’équilibrer. L'équilibre demande beaucoup de pratique, de connaissance des réactions, des formules, des frontières, des symboles et des techniques. Souvent, les étudiants perdent espoir et ont du mal à comprendre. Si vous avez également des difficultés, tout ce dont vous avez besoin est une feuille de travail sur les équations d’équilibrage avec les réponses.
Comprendre les méthodes et les astuces peut vous permettre d’équilibrer plus facilement l’équation chimique. Lorsque vous équilibrez l’équation, vous établissez automatiquement une relation mathématique entre les produits et les réactifs. Si vous êtes souvent confus lors de l’équilibrage des équations chimiques, explorez quelques tenants et aboutissants et astuces pour équilibrer les équations chimiques dans l’article.
Qu'est ce qu'une equation chimique?
Une équation chimique est le symbole en chimie qui représente une réaction chimique à l'aide de formules chimiques. Il contient les substances chimiques qui participent à la réaction. Contient des réactifs et des produits. Les réactifs sont les éléments qui réagissent entre eux lors d'une réaction chimique, tandis que les produits sont les éléments que l'on obtient après la réaction.
L’équation chimique a les produits du côté droit, tandis que les réactifs sont écrits du côté gauche. Les deux sont séparés par une flèche. Par exemple, 2H2 + O2 -> 2H20 indique qu’il y a 4 atomes d’hydrogène et 2 atomes d’oxygène des deux côtés de l’équation. Le nombre de réactifs doit être égal au nombre de produits. Lorsque les élèves obtiennent de grandes équations chimiques sur une feuille de travail sur les équations d’équilibrage, ils trouvent souvent cela très difficile. Nous vous aiderons également à comprendre à travers quelques conseils dans cet article, pour vous aider à traverser le processus en douceur.
Feuilles de travail sur l’équilibrage des équations chimiques

![]()
#01

![]()
#02

![]()
#03

![]()
#04

![]()
#05

![]()
#06

![]()
#07

![]()
#08

![]()
#09

![]()
#dix
Pourquoi est-il important d’équilibrer les équations chimiques ?
Lorsque vous devez équilibrer des équations chimiques, vous vous demandez souvent pourquoi vous le faites. Certains élèves ne s'en soucient pas et équilibrent simplement parce qu'on le leur demande, mais certains essaient d'être logiques et veulent connaître la véritable raison derrière cet équilibre. Il faut l’équilibrer car il doit y avoir un nombre égal d’atomes des deux côtés de l’équation. De plus, il doit être équilibré des deux côtés, en raison de la loi de conservation de la masse.
La loi stipule qu'il doit y avoir une quantité égale avant et après l'expérience, garantissant que la quantité et la qualité restent les mêmes. Cette loi a été établie par Antoine Laurent en 1789. Il a exploré le fait que la matière ne peut être créée ou détruite. De plus, les équations doivent s’équilibrer correctement car les équations inégales ne sont pas des équations correctes. Peu importe s'ils contiennent des articles et des quantités corrects, ils ne seront pas considérés comme exacts. De plus, ces équations déséquilibrées ne peuvent pas être utilisées pour calculer des réactions chimiques .
En plus de cela, les équations chimiques doivent être équilibrées même parce que les produits chimiques ne réagiront pas tant que vous n’aurez pas ajouté les rapports molaires corrects. De plus, l’équation équilibrée est nécessaire pour déterminer la quantité de réactif dont vous auriez besoin pour fabriquer le produit spécifique. Cela signifie simplement que les bons produits ne se formeront que si vous ajoutez la bonne quantité de réactifs.
Certains élèves trouvent vraiment difficiles les équations d’équilibre dans la feuille de travail sur les équations d’équilibre. C’est difficile et peut nécessiter du combat, mais tout ce que vous avez à faire est de vous entraîner, d’être patient et d’avoir une bonne mémoire. Au début, vous pourriez rencontrer des difficultés, mais vous devez continuer à travailler dur et vous réussirez sûrement. Nous expliquerons les conseils ci-dessous dans notre section bonus, mais en voici quelques-uns brièvement. Vous devez apprendre les réactions et écrire des formules pour les réactifs. Comprendre le concept et équilibrer l’équation. Une fois que vous aurez compris le concept, vous serez surpris de voir à quel point l’équilibrage sera facile.Cela peut sembler difficile à croire pour le moment, mais continuez à travailler sur cette équation et tout d’un coup, ils s’enclencheront. Une fois que vous aurez compris la logique derrière eux, plus rien ne vous arrêtera.
Feuilles de travail sur les équations d’équilibrage avec réponses

![]()
#onze

![]()
#12

![]()
#13

![]()
#14

![]()
#quinze

![]()
#seize

![]()
#17

![]()
#18

![]()
#19

![]()
#vingt
Quels sont les différents types d’équations chimiques ?
Avant de vous aider à comprendre les trucs et astuces pour équilibrer les équations, vous devez d’abord connaître les types d’équations chimiques. Fondamentalement, il existe cinq types d’équations chimiques et leurs réactions. Découvrez-les ci-dessous.
Combinaison chimique ou réaction de synthèse
Il s’agit du type d’équation chimique le plus courant. Dans cette équation chimique, un nouveau produit est formé en combinant deux ou trois combinaisons de réactifs. Par exemple, H 2 + O 2 H 2 O. Il s'agit d'une équation chimique dans laquelle deux atomes d'hydrogène se combinent pour former un produit, l'eau. C'est pourquoi cette réaction est appelée réaction de synthèse. En outre, il s’agit également d’une équation inégale car il y a deux atomes présents pour l’oxygène du côté réactif, alors qu’il n’y a qu’un seul atome du côté oxygène pour le produit. Mais l’équation n’est valable que lorsque le nombre d’atomes et de taupes est égal des deux côtés.Vous pouvez équilibrer l’équation en utilisant la méthode de combustion qui sera expliquée plus tard.
Réaction de décomposition chimique
La réaction de décomposition chimique est la réaction dans laquelle un seul composé est décomposé et donne naissance à deux ou plus de deux produits. Pb(No 3 ) 2 PbO + NO 2 + O 2 . Dans cette équation, le nitrate de plomb est décomposé, qui se décompose pour former du dioxyde d'azote, de l'oxygène et de l'oxyde de plomb. Ceci est un exemple de réaction de décomposition.
Réaction de déplacement ou de remplacement
Une autre réaction chimique très courante est de deux types, à savoir le simple déplacement et le double déplacement. Dans une réaction de déplacement unique, n'importe quel partenaire chimique échange des réactifs vers des produits, tandis que deux ensembles de partenaires chimiques échangent des réactifs vers des produits. Un exemple de réaction de déplacement unique est XY + Z XZ + Y.
Dans cet exemple, le zinc remplacera l’hydrogène de l’acide sulfurique pour former du sulfate de zinc. Comme vous pouvez le constater, un seul cation est échangé ici, ce qui signifie qu’il s’agit d’une simple réaction de déplacement. En reprenant l'exemple similaire, dans la deuxième équation de déplacement chimique, BaCl 2 + NaSO 4 BaSO 4 + 2NaCl serait l'équation. Dans cette équation, l’ion chlorure quitte le baryum et rejoint le sodium.
Réaction de combustion
Il s'agit d'une réaction chimique au cours de laquelle un composé oxygéné et un composé carboné se combinent pour devenir H 2 O et CO 2 . C'est la réaction dans laquelle un composé organique tel que l'oxygène est brûlé, donnant naissance à de l'eau, du dioxyde de carbone ou un autre produit. La combinaison de toute substance avec de l'oxygène entraîne une combustion.
réaction acido-basique
Il s’agit d’une simple réaction chimique où l’acide et la base se combinent pour produire de l’eau et du sel. Cette réaction est également appelée réaction de neutralisation et est plus communément appelée réaction acide-base. Ce sont des types de réactions très importants qui se produisent dans les systèmes biologiques.
Feuille de travail pratique sur l’équilibrage des équations

![]()
#vingt-et-un

![]()
#22

![]()
#23

![]()
#24

![]()
#25

![]()
#26

![]()
#27

![]()
#28

![]()
#29
Comment équilibrer une équation chimique ?
Lorsque les élèves se sentent souvent frustrés, ils choisissent d’équilibrer les réponses des feuilles de travail sur les équations chimiques pour résoudre le problème. Si vous avez également du mal à équilibrer les équations chimiques, veuillez suivre les étapes ci-dessous.
Étape n°1 : Écrivez l’équation déséquilibrée
La première étape pour équilibrer l’équation consiste à écrire la formule chimique des réactifs répertoriés sur le côté gauche de l’équation chimique. Après cela, vous pouvez lister les produits du côté droit de l’équation chimique. Il y a une flèche entre les côtés, indiquant la direction dans laquelle se produit la réaction. Une fois que vous aurez collecté les données déséquilibrées, cela vous aidera à équilibrer l’équation.
Étape n°2 : équilibrer l'équation
Il est désormais temps d’appliquer la loi de conservation de la masse. Cette loi stipule que le même nombre d’atomes doit être présent des deux côtés de l’équation chimique. L’un des moyens les plus simples d’équilibrer l’équation chimique consiste à rechercher un élément qui ne contient qu’un seul réactif et un seul produit. Une fois cet élément équilibré, vous pouvez procéder à l’équilibrage de l’autre. De cette façon, vous pouvez continuer à avancer les uns vers les autres jusqu’à ce que tous les éléments soient équilibrés.
En plaçant le coefficient devant eux, vous pouvez équilibrer les formules chimiques. Souvent, les gens sont confus et ajoutent des indices, ce qui change complètement la formule. Il existe trois méthodes de base pour équilibrer l’équation chimique. Nous expliquerons chacun d’eux ci-dessous dans notre section supplémentaire. Vous pouvez le faire pour n'importe qui qui recherche le type d'équation chimique.
Étape n°3 : indiquer les états de la matière
Enfin, vous devez indiquer les états de matière des produits et réactifs. Vous pouvez utiliser g pour les substances gazeuses. Vous pouvez utiliser l pour les liquides et s pour les solides. Si vous trouvez des espèces dans une solution aqueuse, utilisez aq pour cela.

![]()
#30

![]()
#31

![]()
#32

![]()
#33

![]()
# 3. 4

![]()
#35

![]()
#36

![]()
#37

![]()
#38

![]()
#39

![]()
#41
Méthodes que vous pouvez utiliser pour équilibrer l’équation chimique
Il existe deux types de méthodes couramment utilisées pour équilibrer les équations chimiques. Découvrez-les ci-dessous.
Méthode de réaction de combustion
C’est le type de méthode utilisée pour équilibrer les équations qui contiennent de l’oxygène des deux côtés. Ces éléments sont souvent difficiles à équilibrer. Lorsque vous rencontrez des difficultés pour équilibrer l'équation dans la feuille de travail d'équilibrage des équations chimiques, vous pouvez échouer avec une fraction de ½ et cela équilibrera facilement l'équation. Mais le problème est que vous ne pouvez pas avoir de fraction pour le coefficient, donc doubler tous les coefficients vous aidera à équilibrer l'équation.
Méthode proportionnelle
Il s’agit du deuxième type de méthode pouvant être utilisée pour équilibrer l’équation. Il est utilisé lorsque l’équation chimique est difficile à inspecter. Si vous ne comprenez pas l'équation après quelques minutes, utilisez la méthode des proportions. Assurez-vous de modifier la valeur du coefficient et non de l'indice.
Conseils pour équilibrer les équations chimiques
Si vous êtes également perplexe lors de l'équilibrage des équations chimiques, suivez les conseils pour obtenir les bonnes réponses de la feuille de travail sur l'équilibrage des équations chimiques.
- Conseil n°1 : lorsque vous essayez d'équilibrer des équations chimiques, n'oubliez pas que vous ne pouvez modifier que la valeur du coefficient devant l'élément ou le composé, et non l'indice.
- Conseil n°2 : Vous devez vous rappeler que les ions polyatomiques doivent s’équilibrer dans leur ensemble. Par exemple, le SO 4 doit être équilibré dans son ensemble plutôt que l'oxygène et le soufre séparément.
- Conseil n°3 : N'oubliez pas d'équilibrer d'abord le nombre qui contient le plus d'atomes dans un produit ou un réactif. Assurez-vous que ces éléments ne sont pas de l’oxygène ou de l’hydrogène.
- Conseil n°4 : Vous devez compter le nombre d'atomes de chaque élément des deux côtés et voir si l'équation est équilibrée ou non.
- Conseil n°5 : Lorsque vous réussissez à équilibrer l’équation, assurez-vous de vérifier le coefficient. Il devrait être à son niveau le plus bas.
Limites de l'équation chimique
Il existe certaines limites aux équations chimiques énumérées ci-dessous.
- Certaines équations chimiques ne clarifient pas l’état des substances. Vous pouvez donc ajouter g pour gaz, l pour liquide, s pour solide et vap pour vapeur.
- L'équation chimique ne donne aucune information sur la vitesse de réaction.
- Parfois, l’équation chimique ne donne pas non plus la concentration des substances, c’est pourquoi des termes comme concentré et dilué sont utilisés.
- L’équation chimique ne dira pas si le produit final changera de couleur ou se décolorera. C'est pourquoi il faut le mentionner séparément.
- L’équation chimique ne donne également aucune information sur la vitesse de la réaction.
- Certaines équations et réactions chimiques ont divers effets.
pensée finale
Les élèves auront probablement du mal à équilibrer la feuille de travail sur les équations chimiques. Pour vous aider à résoudre ce problème, nous avons une feuille de travail sur les équations d'équilibrage avec des réponses sur notre site Web principal. Vous pouvez simplement le télécharger et vérifier vos équations chimiques. Entraînez-vous pour votre examen en utilisant ces feuilles de travail et faites de votre mieux. Bonne chance!

![]()
#42

![]()
#43

![]()
#44

![]()
#Quatre cinq

![]()
#46

![]()
#47
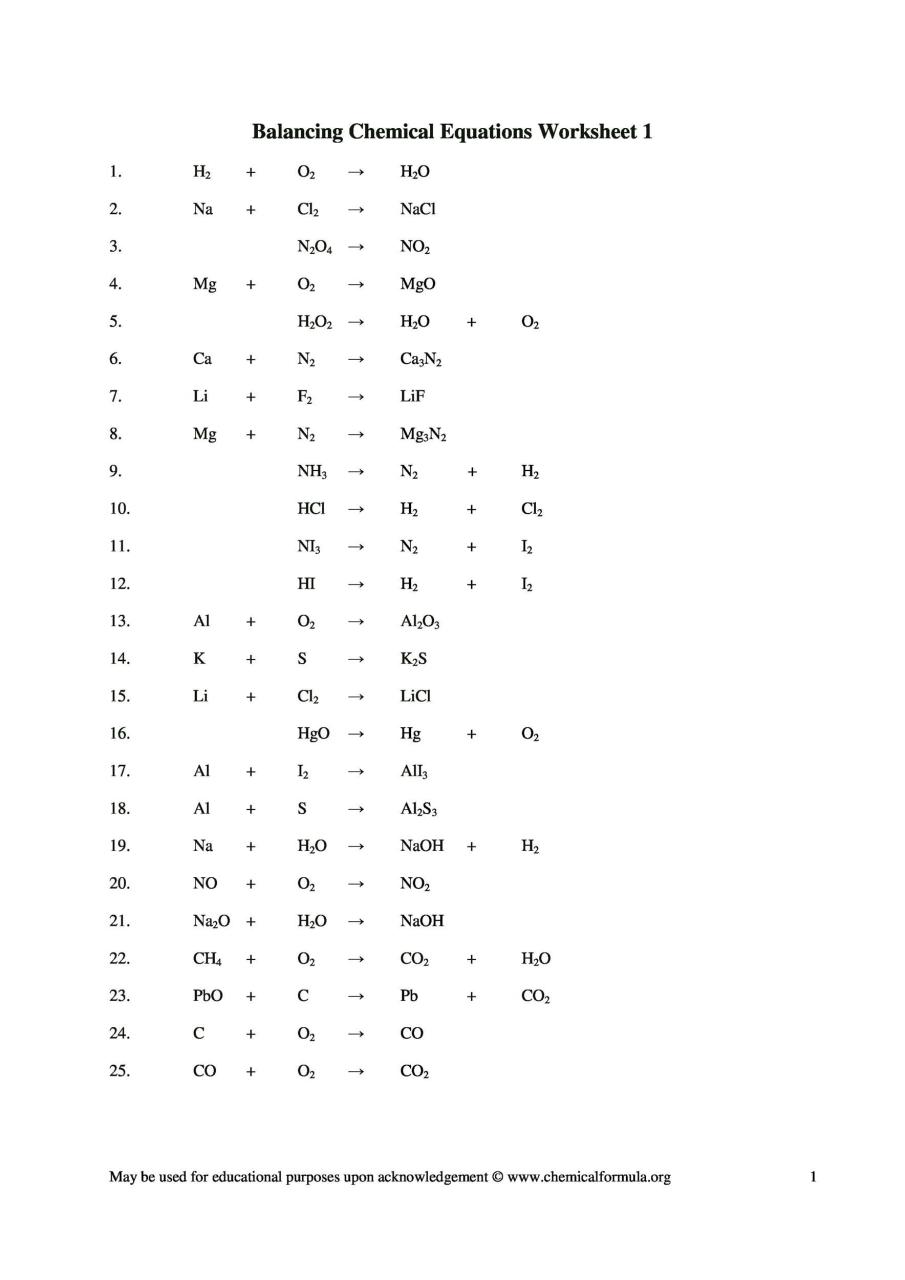
![]()
#48

![]()
#49

Modèles associés